Открывая Окно В Молекулярный Ландшафт Токсикоза Пр
Хесус Р. Реквена
Исследование, опубликованное в журнале Nature Structural & Molecular Biology, теперь раскрывает на атомном уровне первоначальные механизмы прионного токсикоза, обеспечивая понимание патогенных механизмов белкового нейродегенеративного заболевания, вызванного неправильным фолдингом белка.
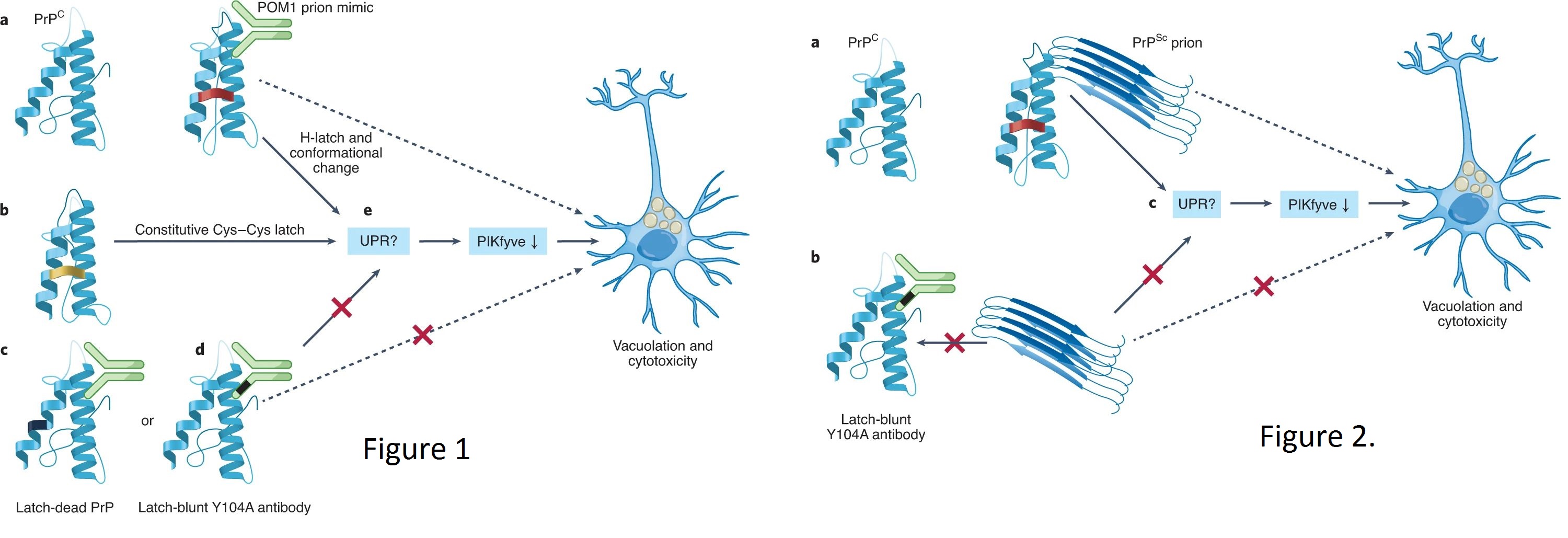
Прионы — причудливые смертельные патогены, состоящие только из белка.1 Они вызывают смертельные нейродегенеративные заболевания, связанные с страшными народными названиями, такими как «смеющаяся смерть», «коровье бешенство» и «болезнь зомби-оленя». Недавние захватывающие прорывы в криоэлектронной микроскопии (крио-ЭМ) позволили расшифровать их структуры и, исходя из них, понять их неортодоксальный механизм пропагации. Но как насчет механизмов, лежащих в основе их токсичности? В этом выпуске журнала Nature Structural & Molecular Biology Фронтцек с коллегами раскрыли начальные этапы механизма прионного токсикоза на атомном уровне и, таким образом, начали сокращать разрыв между токсичностью и структурными исследованиями.2 Прионы могут возникать в чьем-либо мозгу, по-видимому, ex nihilo, путем своего рода спонтанного появления. Однако это явление - не что иное, как чрезвычайно редкое событие неправильного фолдинга, при котором мозговой белок PrPC принимает альтернативную прионную конформацию, PrPSc. После создания PrPSc может заставить PrPC конвертировать в PrPSc по матричному механизму. По мере того, как PrPSc распространяется по мозгу, происходит гибель нейронов.1 Прионы PrPSc также могут пропагировать среди людей. Это происходит вследствие каннибализма, либо ритуального, как при болезни Куру у народа форе, либо промышленного, как при кормлении скота мясокостной мукой в Европе.3 Кроме того, некоторые прионы могут просачиваться из головного мозга в лимфоретикулярную систему, попадать в экскременты (мочу или фекалии), и загрязнять пастбища, как в случае скрепи овец и хронической изнуряющей болезни оленей.3 Существуют межвидовые барьеры заражения, но они не абсолютны, и широкое заражение прионами людей от животных произошло во время эпизоотии губчатой ;;энцефалопатии крупного рогатого скота, охватившей Европу в 1980-х и 1990-х годах (ссылка 3). Недавняя расшифровка структур PrPSc в атомарном разрешении, ставшая возможной благодаря впечатляющим техническим достижениям в области крио-ЭМ, открыла возможность детального понимания этих барьеров передачи [4–6] и произвела революцию в нашем понимании пропагации прионов в целом. Напротив, наше понимание механизма прионного токсикоза на сегодняшний день менее подробно. PrPSc сам по себе безвреден: ему нужно взаимодействие с PrPC для проявления своей токсичности.7 Данное исследование Фронтцека с коллегами анализирует такое взаимодействие на атомарном уровне.2 Авторы основываются на своем предыдущем наблюдении, что PrPC-специфическое антитело, POM1, оказывается мощным миметиком PrPSc, и убивает клетки точно так же, как это делают прионы PrPSc.7 POM1 представляет собой необычный инструмент исследования прионного токсикоза, поскольку в отличие от нерастворимого, гетерогенного и неподвижного PrPSc, он гомогенен, растворим и практически как реагент. Фронтцек с коллегами2 используют спектроскопию ядерного магнитного резонанса (ЯМР) и анализ молекулярной динамики для выявления событий, происходящих, когда POM1 связывает PrPC, то есть самых первый событий в патогенном каскаде, в атомарных деталях. Авторы находят внутримолекулярную водородную связь R208 и H139 в PrPC (мышиная нумерация). Используя ряд классических и элегантных молекулярных и клеточных экспериментов, авторы показали, что эта «H-защелка» R208–H139 необходима и достаточна для проявления токсикоза POM1. Таким образом, введение «мёртвой защелки» заменой R207A запрещает токсикоз в органотипических культивируемых срезах мозжечка (COCS), тогда как введение PrP с конститутивной защелкой R207C-I138C приводит к конститутивному токсикозу в той же модели культуры (Рис. 1).
Рис. 1. Связывание миметика приона PoM1 вызывает H-защелку в PrPС, первое событие в токсикозном каскаде. А) При связывании со своим специфическим эпитопом антитело POM1 вызывает конформационное изменение в PrPC, включающее водородную связь R208 с H139 (мышиная нумерация), называемую H-защелкой. Конформационные изменения расширяются на N-концевой гибкий хвост PrPC. В) Мутант PrPC, имеющий конститутивную защелку Cys-Cys в том же положении, конститутивно токсичен. С, D) Мутация, препятствующая созданию H-защелки (С), или модифицированный POM1, сохраняющий свою способность связываться с PrPC, но не способный вызывать H-защелку (D), приводит к отмене токсикоза. Е) Во всех случаях токсикоз может проявляться или не проявляться за счет активации респонса на развернутый белок (uPR) с последующим истощением киназы PIKfyve, что в конечном итоге приводит к вакуолизации.
Рис. 2. Защелкивающиеся антитела не только безвредны для клеток COCS, но и защищают культуру от вызванного прионами токсикоза. А) Взаимодействие PrPSc с PrPC необходимо для его токсикоза в органотипических культивируемых срезах мозжечка (COCS). В) В присутствии защелкивающегося антитела, способного связывать PrPC, но не способного вызывать H-защелку, токсикоз PrPSc для COCS нивелируется. С) В обоих случаях токсикоз может проявляться или не проявляться за счет активации uPR и последующего истощения киназы PIKfyve, что в конечном итоге приводит к вакуолизации.
Затем авторы оценили эффект «затупления» POM1, создавая мутации, не меняющие его способность связывать PrP, но устраняющие его способность вызывать H-защелку (hcY104A). Как и ожидалось, hcY104A безвредны для экспрессирующих PrPC COCS, в отличие от токсичных POM1 дикого типа (Рис. 1). Более того, «защелкивающиеся» антитела защищают экспрессирующие PrPC COCS от токсикоза экзогенного PrPSc, вероятно, занимая его сайт связывания (Рис. 2). Наконец, hcY104A трансдуцировали мышам внутривенной инъекцией нейротропного адено-связанного вирусного вектора, а затем животных заразили прионами. Все обработанные мыши умерли от прионоза, хотя уровни экспрессии hcY104A положительно коррелировали с временем выживания.2 Создание H-защелки вызывает структурные изменения, затрагивающие отдаленные части PrPC, включая его N-концевой гибкий хвост, что доказано ЯМР (ссылка 2). Ранее публиковали, что гибкий хвост, включающий примерно половину последовательности PrPC, играет ключевую роль в патогенном каскаде.7 Но что происходит сразу после активации этого глобального конформационного переключателя? Предыдущие исследования тех же авторов показали, что прямой причиной вакуолизации, вызванной прионами или приономиметиками, становится истощение PIKfyve, вызванное, в свою очередь, активацией респонса на развернутый белок (UPR) (ссылки 7,8). Следовательно, является ли вызванное H-защелкой конформационное изменение PrPC, возможно гибкого хвоста, достаточным для вызова UPR? Данные, основанные на ЯМР, показывают конформационные изменения во всем PrPC, которые, тем не менее, не меняют его общей архитектуры. Таким образом, экстенсивного развертывания не происходит, и прямая активация UPR кажется маловероятной. Действительно, когда PrP, содержащий конститутивную защелку Cys-Cys, ввели в COCS, никаких изменений UPR не наблюдалось, несмотря на заметный токсикоз.2 Это предполагает, как признают Фронтцек, Барделли и их коллеги, что ось UPR-PIKfyve не может быть ключевым механизмом токсикоза их модели. В таком случае, что это? Как преобразуется конформационное изменение PrPC, проводимое H-защелкой, чтобы в конечном итоге вызвать вакуолизацию и гибель клеток, как в модели Фронтцека, Барделли и коллег, так и in vivo? Это интригующие вопросы без сомнения будут рассмотрены в ближайшее время. В какой степени эти результаты могут быть экстраполированы на другие нейродегенеративные заболевания, связанные с неправильным фолдингом белков? До недавнего времени считалось, что PrPSc структурно сильно отличается от прионоидов A;, тау или ;-синуклеина.9
Все эти амилоиды имеют классические стеки параллельных бета-цепей in-register (PIRIBS).10 Напротив, PrPSc считался ;-катушкой с 4 звеньями.11 Однако крио-ЭМ-исследования только что показали, что PrPSc также относится к PIRIBS, по существу похож на пропагативные амилоиды A;, тау или ;-синуклеина. Таким образом, наиболее выгодной гипотезой стало то, что амилоиды A;, тау и ;-синуклеина могут иметь, по крайней мере, некоторые общие с PrPSc токсикозные пути. Могут ли ранние олигомеры A;, тау или ;-синуклеина, считающиеся токсичными при этих заболеваниях,12 иметь рецептор, родственный PrPC? Это заманчивое предположение. Фактически высказано предположение, что сам PrPC является этим рецептором.13 Эти разные нейродегенеративные заболевания имеют общие патологические признаки, но они также имеют различия. Предложили ряд разных механизмов, но без окончательных доказательств нет ни у одного из них.1,12 Возможное окончательное выяснение всей серии патогенных событий, происходящих при прионозах, которые сейчас замечены, несомненно, даст подсказки и подскажет, где искать молекулярные механизмы других, более распространенных и разрушительных нейродегенеративных заболеваний.
; Хесус Р. Реквена
;; Институт биомедицинских исследований CIMUS, Университет Сантьяго-де-Компостела-IDIS, Сантьяго-де-Компостела, Испания.
;электронный адрес: jesus.requena@usc.es
Опубликовано онлайн: 10 августа 2022 https://doi.org/10.1038/s41594-022-00817-4
Литература
1. Carlson, G. A. & Prusiner, S. B. Int. J. Mol. Sci. 22, 4861 (2021).
2. Frontzek, K. et al. Nat. Struct. Mol. Biol. https://doi.org/10.1038/s41594-022-00814-7 (2022).
3. Aguzzi, A. J. Neurochem. 97, 1726–1739 (2006).
4. Kraus, A. et al. Mol. Cell. 81, 4540–4551e6 (2021).
5. Hoyt, H. et al. Nat. Commun. 13, 4005 (2022).
6. Manka, S. W. et al. Nat. Commun. 13, 4004 (2022).
7. Herrmann, U. S. et al. PLoS Pathog. 11, e1004662 (2015).
8. Lakkaraju, A. K. K. et al. EMBO Mol. Med. 13, e14714 (2021).
9. Era;a, H. Prion 13, 41–45 (2019).
10. Sawaya, M. R., Hughes, M. P., Rodriguez, J. A., Riek, R. & Eisenberg, D. S. Cell 184, 4857–4873 (2021).
11. Spagnolli, G. et al. PLoS Pathog. 15, e1007864 (2019).
12. Ashe, K. H. Alzheimers Dement. 16, 1561–1567 (2020).
13. Gunther, E. C. & Strittmatter, S. M. J. Mol. Med. 88, 331–338 (2010).
Благодарности
Поддерживается Министерством Науки и Инноваций Испании (грант PID2020-117465GB-I00, частично финансируемый фондами ЕС).
Конкурирующие интересы
Автор заявляет об отсутствии конкурирующих интересов.
Свидетельство о публикации №222090801208